摘要:2025年10月10號,國務院公布《生物醫學新技術臨床研究和臨床轉化應用管理條例》(以下簡稱《條例》),自2026年5月1日起施行。
2025年10月10號,國務院公布《生物醫學新技術臨床研究和臨床轉化應用管理條例》(以下簡稱《條例》),自2026年5月1日起施行。《條例》旨在規范生物醫學新技術臨床研究和臨床轉化應用,促進醫學科學技術進步和創新,保障醫療質量安全,維護人的尊嚴和健康。
此次《條例》的頒布作為重大行業政策支撐及利好,標志著中國在基因編輯、干細胞、體細胞治療技術等前沿生物醫學新技術領域,從過去相對模糊的監管狀態,邁向了權責清晰、路徑明確的規范化發展新階段 ;同時規范了生物醫學新技術臨床研究與轉化應用的要求和流程,對臨床研究機構、生物技術企業及整個產業生態的深遠影響,以制度保障促進醫學進步,推動醫療技術創新及行業高質量發展。菲鵬對文件內容第一時間予以深度解讀。
政策歷史沿革
根據公開信息,此次國務院公布的《條例》,相關部委已經過歷時六年準備:國家衛健委在2019年2月發布并公開征求意見的《生物醫學新技術臨床應用管理條例(征求意見稿)》(以下簡稱“《征求意見稿》”);同年9月在多個高校網站公布了《生物醫學新技術臨床研究和臨床轉化應用管理條例(草案)》掃描版文件(和本次審議通過文件同名,以下簡稱“《條例掃描版》”);后幾經沉寂,在年初公布的最新《國務院2025年度立法工作計劃》中,《生物醫學新技術臨床研究與轉化應用管理條例》已被列為擬制定或修改的行政法規之一。2025年9月12日的國務院常務會議上,會議審議通過《生物醫學新技術臨床研究和臨床轉化應用管理條例(草案)》。
政策內容對比分析
結合官方發布的兩份公開文件(《條例》及《征求意見稿》),筆者對其中部分關鍵內容予以對比及解讀,以求探尋監管機構釋放的監管思路:(不同顏色指代:紫色--明顯差異的;紅色--新增內容)

正式稿相較于征求意見稿突出體現了監管的科學性和高效性,后續需關注衛健委的配套實施文件,期待具體實施標準&細則。
政策內容關鍵價值解析
1.明確生物醫學新技術定義,提供清晰的應用管理邊界
長期以來,以基因治療、細胞治療等前沿療法為代表的醫學技術面臨著“創新走不出去”的困境,其中核心痛點在于“身份不明”及“路徑模糊”。一方面,在細胞與基因治療(CGT)領域雙軌制的監管范疇下,技術軌開發路徑由于定義不清無法真正獨立運行;另一方面,概念不清導致不同地域監管部門、企業及研究機構對概念把握標準的差異使得行業長期處于監管難度大、魚龍混雜的局面。
國家衛健委于2018年出臺的《醫療技術臨床應用管理辦法》就醫療技術的臨床應用作出具體的規定。根據《醫療技術臨床應用管理辦法》,醫療技術被定義為“醫療機構及其醫務人員以診斷和治療疾病為目的,對疾病作出判斷和消除疾病、緩解病情、減輕痛苦、改善功能、延長生命、幫助患者恢復健康而采取的醫學專業手段和措施”。
在此基礎上,《條例》定義了生物醫學新技術存在“生物醫學”和“新技術”等方面的特殊因素,明確的定義為企業后續的產品開發及臨床應用提供了清晰的邊界。這一清晰的界定,為菲鵬等早在CGT領域深度布局的企業提供了明確的發展預期。以其旗下MOTE Therapeutics(簡稱MOTE)所專注的核酸藥物創新靶向遞送技術為例,正好落在這一監管范疇內,迎來了明確的政策環境。
2.建立明確的臨床前-臨床研究-應用轉化的銜接路徑及商業化出口
政策整體通過清晰且明確的監管路徑指引生物醫學新技術從臨床前-臨床研究-應用轉化完整且明確的路徑:
· 臨床前-臨床研究:經臨床前研究證明安全、有效的生物醫學新技術,方可獲準開展臨床研究,這一過程始于對技術“充足科學依據”的嚴格要求,旨在確保任何在人體上進行的試驗都具備堅實的科學基礎和初步的安全數據。同時從征求意見稿的審批機制重新規定延續當前的備案制也體現監管部門對于提升專業性技術審核效率的充分考量。
· 臨床研究-應用轉化:臨床研究證明安全、有效、符合倫理的生物醫學新技術,經國務院衛生主管部門審查批準后,可以轉化應用于臨床。同時參考之前干細胞管理條例轉化應用相關規定,干細胞制劑完成臨床研究后,可將研究結果作為技術性申報資料提交,用于申請藥品注冊臨床試驗。這為干細胞技術從實驗室走向臨床應用提供了清晰路徑,縮短了研發到上市的時間周期,加速創新成果的轉化。生物醫學新技術的臨床研究數據作為后續藥品申報材料在具有相關實踐基礎上也同樣“未來可期”。
同時從商業路徑上完成應用轉化意味著在臨床端能夠獲取明確的收費標準:《條例》第20條明確臨床研究發起機構及研究機構不得向受試者收取與生物醫學新技術臨床研究有關的費用。在其批準進入臨床應用后明確可以收取費用。
3.明確的準入標準進一步規范行業發展
開展生物醫學新技術臨床研究具有明確的開展門檻,將進一步出清不合規機構,保證產業在科學性和規范性基礎上良性發展,資源也能夠集中在真正有高質量研究能力的頭部機構和專家。
· 機構資質:必須是三級甲等醫院。有符合要求的臨床研究學術委員會和倫理委員會,同時資金來源明確;這一規定確保了研究活動必須在具備雄厚醫療實力、完善的應急處理能力和高質量管理體系的機構中進行。
· 臨床研究者資質:具備執業醫師資格和高級職稱,且擁有良好的科研信譽。
4.CGT領域‘雙軌制’管理模式下技術軌具備獨立發展廣闊空間
生物醫學新技術和先進治療藥品是中國監管體系下針對CGT等前沿領域兩個既緊密關聯又存在本質區別的術語,同時也是雙軌制管理下相互銜接但又有所區分的發展路徑(技術軌&藥品軌) 。
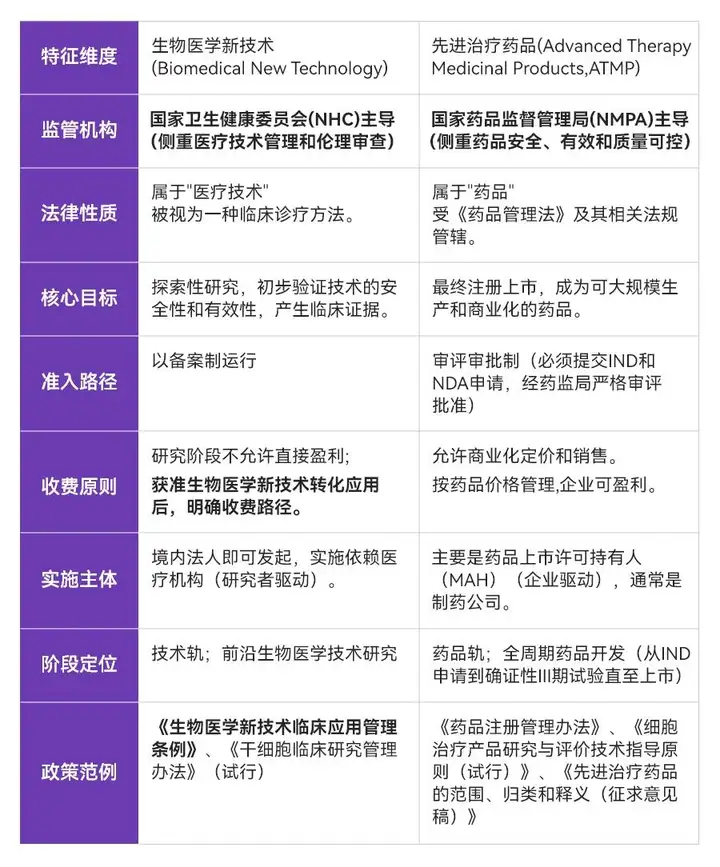
既往相較于藥品軌完善的定義規范、開發流程以及監管審批標準,技術軌往往落入為之服務的附屬角色;伴隨著《條例》的出具及法規完善,技術軌監管支持下同樣建立了合規清晰的早研-臨床研究-轉化應用商業化的閉環結構。雙軌制的獨立并行發展為企業策略上帶來了更加豐富的選擇,進一步激活創新型企業的活力和行業創造性。
前瞻布局:菲鵬深度卡位CGT關鍵底層技術
在政策利好的大背景下,菲鵬等企業前瞻性布局帶來的技術紅利正在政策加持下加速轉化為發展優勢。
菲鵬一直致力于診療前沿技術與解決方案的探索,由菲鵬和Robert Alexander Wesselhoeft(Alex)博士共同創立的MOTE Therapeutics(簡稱MOTE)是一家專注于核酸藥物創新靶向遞送技術和應用產品研發的創新公司,成立至今已在中美兩地分別組建了高度創新的核心研發團隊,搭建了全球領先的環狀RNA平臺以及通用型靶向遞送平臺。其中,核心技術平臺MOBILIZE采用非化學偶聯方式進行LNP的靶向修飾,可實現細胞水平的高效主動靶向遞送,且可兼容不同cargo、不同LNP、不同binder,拓展性極強。
MOBILIZE解決了目前行業中靶向LNP技術面臨的靶向特異性不足、制造工藝復雜以及遞送效率不高等關鍵難題,遠優于目前行業中其他靶向遞送技術,是領域內最具差異化和領先性的靶向遞送平臺。當前CGT領域正在處于由體外療法快步邁入體內療法的關鍵時期,而MOBILIZE憑借安全、高效、精準的靶向遞送特性,必然能在這一過程中拓展出無限的應用前景。
憑借世界級的科學實力、顛覆性的遞送技術引擎,以及拓展RNA療法技術邊界的使命感,MOTE將致力于引領靶向遞送領域、開拓全新治療范式。MOTE目前正面向全球尋求合作伙伴,共同推進臨床前研究及更好疾病治療方案的打造。
總體而言,此次法規的完善為真正具有創新價值的技術提供一個合法、清晰的“身份”和發展路徑,打通從基礎研究到臨床應用的轉化鏈條。明確的法規路徑將極大增強投資人的信心,資本將更加青睞那些擁有真正“硬科技”、扎實臨床前研究數據和強大合規能力的團隊,行業將回歸技術和價值本身。另一方面,合規框架的清晰化,也意味著探索性臨床研究的風險被更精確地定義和管理,試錯成本和時間將大大縮短。以政策為錨驅動中國CGT產業蓬勃繁榮。
香港,2025 年 12 月 11 日 — 香港上合發展(下稱 「集團」)宣布正式進軍中東及北非市場...
 1天前
1天前9月24日,在剛剛開幕的2025云棲大會上,阿里巴巴集團CEO、阿里云智能集團董事長兼CEO吳泳銘發...
 2025-09-24
2025-09-24近日,國內消費電子精密結構件制造領軍企業——重慶百鈺順精密工業股份有限公司(以下簡稱“百鈺順”)在A...
 2025-09-24
2025-09-242025年9月,在中國信息通信研究院和中國通信企業協會主辦的第八屆“綻放杯”5G應用征集大賽- 5G...
 2025-09-24
2025-09-24香港,2025年9月21日 —— 香港上合發展(ALMAD Group,下稱“集團”)正式宣布成立,...
 2025-09-24
2025-09-24投資家網(www.hbzbj.cn)是國內領先的資本與產業創新綜合服務平臺。為活躍于中國市場的VC/PE、上市公司、創業企業、地方政府等提供專業的第三方信息服務,包括行業媒體、智庫服務、會議服務及生態服務。長按右側二維碼添加"投資哥"可與小編深入交流,并可加入微信群參與官方活動,趕快行動吧。
